NanoKnife – nieodwracalna elektroporacja
artykuł ukazał się w Przeglądzie Urologicznym 2013/2 (78)
Streszczenie
W ostatnich miesiącach na rynku urologicznym w Polsce pojawiła się nowa opcja w leczeniu chorych na raka stercza – NanoKnife. Metoda polega na wykorzystaniu zmiennego pola elektrycznego przepływającego przez obszar docelowy, przy czym przyłożone napięcie osiąga wartości do 3000 V. Proces ten prowadzi do powstania nieodwracalnych porów w błonie komórkowej, co w konsekwencji prowadzi do śmierci komórki. To zjawisko biofizyczne określane jest mianem nieodwracalnej elektroporacji (irreversible elektroporation – IRE) i właśnie ono wykorzystywane jest w niszczeniu ogniska nowotworowego w tkance stercza podczas zabiegów z użyciem NanoKnife. Zaletą elektroporacji jest zaoszczędzenie struktur kolagenowych, np. ściany naczyń krwionośnych oraz nerwów, istotnych dla zachowania ważnych czynności fizjologicznych. W artykule omówiono zalety i nadzieje związane z zastosowaniem IRE w leczeniu raka stercza oraz zagadnienia i problemy wyłaniające się w związku z zastosowaniem tej nowatorskiej metody terapeutycznej.
Na polskim rynku urologicznym w ostatnich miesiącach pojawiła się nowa opcja terapeutyczna w leczeniu chorych na nowotwór stercza – NanoKnife. Jest to urządzenie wykorzystujące unikalną formę efektu biologicznego określanego mianem nieodwracalnej elektroporacji (irreversible electroporation – IRE). Nieodwracalna elektroporacja jest nową, nietermalną metodą ablacji polegającą na przepływie krótkich impulsów elektrycznych przez tkankę, powodujących powstawanie nieodwracalnych otworów (porów) w błonie komórkowej, prowadząc do jej zwiększonej przepuszczalności, a ostatecznie do śmierci komórki. Przepływ zmiennego pola elektrycznego przez komórki żywego organizmu powoduje w nich zmiany zależne od doboru parametrów fizycznych płynącego prądu [1]. W zależności od przyłożonego napięcia, ilości impulsów oraz czasu trwania poszczególnego impulsu w komórce dochodzi do zmian jej przepuszczalności o charakterze odwracalnym (reversible electroporation – RE; przyłożone napięcie wynosi 300–600 V) lub nieodwracalnym (irreversible electroporation – IRE; przyłożone napięcie wynosi 1500–3000 V).
Elektroporacja jako zjawisko fizyczne znalazła dotąd swoje zastosowanie w różnych dziedzinach biotechnologii i medycyny. W jej odwracalnej formie wykorzystywana jest w elektrogenoterapii (do modyfikacji genetycznej komórek), w której wykorzystuje się powstawanie porów w błonie komórki w celu wprowadzania in vivo genów do jej wnętrza [2]. Elektrochemoterapia to kolejna dziedzina wykorzystująca możliwość odwracalnego zwiększania przepuszczalności błon komórkowych w celu ułatwienia wnikania makromolekuł leku do wnętrza komórek w obszarze docelowym (np. naturalnie nierozpuszczalne w wodzie leki przeciwnowotworowe, jak bleomycyna, w skojarzeniu z elektroporacją są stosowane w celu ablacji tkanki nowotworowej) [3]. Właściwości elektroporacji nieodwracalnej zostały dokładnie zbadane i znalazły zastosowanie w systemach komórkowych in vitro. IRE wykorzystuje się np. jako efektywną metodę likwidacji biologicznego skażenia wód spowodowanego zarówno przez bakterie gram‐ujemne, jak i gram‐dodatnie. Pierwszymi, którzy sugerowali, iż IRE w swojej czystej postaci może być zastosowana do chirurgicz‐ nej ablacji tkanek, byli Davalos i Rubinsky [4]. Spekulowali oni, że metoda ta może mieć przewagę nad dotychczas stosowanymi termicznymi formami ablacji. Ich przewidywania zostały później potwierdzone w badaniach na zwierzętach – badania dotyczyły zmian zachodzących w wątrobie i sterczu zwierząt poddanych IRE [5]. Wykazano, iż poddanie tkanek działaniu IRE prowadzi do szybkiego powstania obszaru uszkodzenia z następową jego przebudową przy jednoczesnym zaoszczędzeniu nieuszkodzonych struktur kolagenowych, zachowaniu naczyń krwionośnych, nerwów, cewki moczowej. Te właściwości, różniące IRE od termicznych form ablacji (krioterapia, termoterapia), pozwoliły na zastosowanie metody w niszczeniu ognisk nowotworowych w trudno dostępnych obszarach narządów miąższowych człowieka, a przede wszystkim w przypadkach szczególnie skomplikowanych (z uwagi na sąsiedztwo krytycznych struktur, jak naczynia, nerwy, drogi żółciowe) lokalizacji guza.

Dlatego też NanoKnife znalazł dotychczas zastosowanie w ablacji guzów wątroby, trzustki i nerek. Terapia guzów we wspomnianych narządach dotyczyć może zarówno niszczenia ognisk pierwotnych nowotworu, jak i zmian o charakterze przerzutowym. W każdym przypadku zabieg ma na celu całkowite zniszczenie ogniska nowotworowego. W przypadku raka stercza zastosowanie IRE może mieć dwojaki charakter. W pierwszym przypadku rozpatrujemy zniszczenie całej struktury stercza, tak jak to dzieje się w innych terapiach radykalnych, np. teleradioterapii czy brachyterapii. U podstaw takiego postępowania leży założenie, iż rak stercza ma często charakter wieloogniskowy, z czego wynika dążenie do zniszczenia całej tkanki narządu [6]. Racjonalizm takiego postępowania umacnia fakt, iż destrukcja całego stercza znacznie ułatwia monitorowanie przebiegu leczenia opartego w głównej mierze na okresowej kontroli poziomu PSA w surowicy, tak jak przy brachyterapii czy napromienianiu wiązkami z pól zewnętrznych. Drugim sposobem propagowanym przez większość ośrodków posługujących się obecnie techniką IRE w leczeniu raka stercza jest niszczenie jedynie samego ogniska nowotworu zlokalizowanego w tkance stercza. Jest to tak zwana terapia ogniskowa, fokalna (focal therapy), zyskująca wśród urologów na świecie w ostatnim okresie wielu zwolenników [7]. Zwolennicy terapii fokalnej motywują ten sposób leczenia intencją wyboru metody minimalnie inwazyjnej, pozwalającej zachować choremu jego podstawowe funkcje fizjologiczne (potencję, prawidłowe trzymanie moczu), niepowodującej powikłań. Zważywszy na charakter zmian biofizycznych zachodzących pod wpływem IRE w żywych tkankach (zachowanie nieuszkodzonych struktur kolagenowych, naczyń, nerwów), NanoKnife wydaje się doskonale spełniać te kryteria nawet w sytuacjach lokalizacji guza w okolicy struktur krytycznych, jak cewka moczowa czy pęczki naczyniowo‐nerwowe. W przypadku wyboru tej opcji leczenia istnieje oczywiście margines niepewności dotyczący radykalności przeprowadzonej terapii.
Obecne podejście do jednostki chorobowej, jaką stanowi rak stercza, daje lekarzowi i jego choremu szeroki wachlarz postępowania. Na jednym biegunie tego szerokiego spectrum metod leczenia jawią się metody „agresywne” z prostatektomią radykalną na czele, podczas gdy na drugim pacjent ma prawo do przyjęcia postawy wyczekującej, opartej jedynie na bacznej obserwacji (watchful waiting) przebiegu schorzenia. W takim ujęciu przedmiotu terapia fokalna, polegająca na zniszczeniu zlokalizowanego ogniska nowotworu w tkance stercza, wydaje się być logicznym, konsekwentnym rozszerzeniem koncepcji watchful waiting. Przeprowadzenie terapii ogniskowej w tych przypadkach minimalizuje ryzyko związane z przyjęciem postawy zachowawczej (jedynie obserwacja), a jednocześnie stwarza choremu szansę leczenia niemającego wpływu na obniżenie jego jakości życia. Podstawowym zarzutem stawianym przy wyborze leczenia fokalnego w przypadku raka stercza jest jego wieloogniskowość. Jednakże przegląd literatury patologii raka stercza dowodzi, iż znaczna liczba pacjentów to chorzy z pojedynczym ogniskiem nowotworu, a ponadto znaczna liczba dodatkowych ognisk raka to zmiany nieistotne klinicznie [8–11]. W badaniach przeprowadzonych przez Djavana i wsp. na preparatach uzyskanych w wyniku prostatektomii radykalnych dowiedziono, iż jedna trzecia operowanych to przypadki z rakiem zlokalizowanym w jednym ognisku. Inne badanie, przeprowadzone przez Villarsa i wsp. [9] wykazało, że 80% mnogich guzów w sterczu to zmiany nieprzekraczające 5 ml, co oznacza, iż są to prawdopodobnie ogniska nieistotne klinicznie. Podobne wnioski potwierdzane były również przez innych autorów [11]. Pomimo to pacjenci, którzy z wyboru (głównie z powodu pragnienia zachowania potencji) poddawani są terapii ogniskowej z zastosowaniem NanoKnif, wymagają specjalnego przygotowania polegającego na wykonaniu specjalnego stagingu, a w zasadzie mappingu stercza opartego na zasadach opracowanych na konferencji poświęconej lokalnemu leczeniu raka stercza na Florydzie (Consensus Conference on Focal Treatment of Prostatic Carcinoma, Celebration; Florida, February 24 2006) [12].
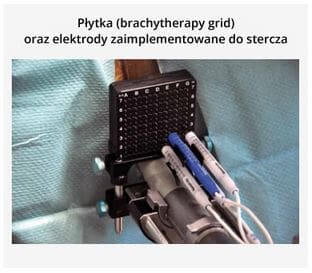
Procedura polega na wykonaniu w znieczuleniu ogólnym przezkroczowej biopsji stercza przy wykorzystaniu płytki stosowanej podczas brachyterapii (brachytherapy grid) z pobraniem oznakowanych wycinków w odstępach 5‐milimetrowych, stwarzających specyficzną mapę stercza. Według oceny Crowforda i wsp. ten sposób „mapowania” stercza wykazuje 95% czułość w lokalizowaniu guzów mających znaczenie kliniczne. Przeprowadzenie zabiegu IRE polega na jak najwierniejszym odtworzeniu warunków uzyskanych podczas wykonywania „przezkroczowej mapy stercza” oraz wprowadzeniu elektrod NanoKnif w obręb obszaru nowotworu zlokalizowanego podczas biopsji guza (nie zawsze widocznego w obrazie TRUS podczas wykonywania zabiegu) [13]. Monitorowanie przebiegu leczenia pacjentów poddanych terapii fokalnej, zważywszy na niedoskonałość dostępnych obecnie metod obrazowania w diagnostyce medycznej oraz brak możliwości wyciągania wniosków z pooperacyjnego zachowania się poziomu PSA (zniszczone jedynie ognisko guza, a nie cały narząd będący miejscem „produkcji” antygenu), pociąga za sobą wykonywanie powtarzalnych biopsji stercza opartych na opisanej powyżej metodyce celem dokonania mikroskopowej oceny radykalności leczenia. Tak intensywna metodyka kontroli pacjentów zakłóca niestety podstawowe założenie małej inwazyjności metody, jaką stanowi „ogniskowe podejście” do leczenia raka stercza. Opracowanie wiarygodnej metodyki diagnostyki obrazowej, pozwalającej na jednoznaczną ocenę stanu biologicznego leczonego ogniska nowotworu, mogłoby w znacznym stopniu ograniczyć uciążliwości związane z obecnymi zasadami obowiązującymi w trakcie follow up.
Pomimo wspomnianych niedoskonałości i ograniczeń nieobcych każdej nowatorskiej technologii stosowa‐ nej w medycynie, IRE bez wątpliwości stanowi metodę przyszłościową i cenny oręż w asortymencie opcji leczenia nowotworu stercza. Rosnące zainteresowanie technologią IRE potwierdza fakt, iż dotychczas wykonano na świecie około 2000–2500 zabiegów z zastosowaniem NanoKnife, w tym 900–1100 dotyczyło guzów wątroby, 500–700 guzów trzustki, 100–200 guzów nerki, a około 100–200 zabiegów dotyczyło tzw. innych lokalizacji, np. guzów płuca. Doświadczenie dotyczące leczenia nowotworu stercza obejmuje około 300–400 zabiegów wykonanych we wszystkich ośrodkach. Obecnie główną postacią w leczeniu guzów stercza z zastosowaniem IRE jest prof. Mark Emberton z Londynu. W Polsce wykonano dotychczas 4 procedury IRE u chorych na raka stercza. Wykonał je autor niniejszego opracowania, bazując na doświadczeniu zdobytym podczas wykonywania zabiegów brachyterapii raka stercza. Pierwszy zabieg IRE z użyciem NanoKnife miał miejsce 8 marca 2012 roku w Centrum Onkologii w Bydgoszczy podczas konferencji dotyczącej mało inwazyjnych technik stosowanych w leczeniu nowotworów. Trzy spośród wymienionych zabiegów obejmowały całą tkankę stercza, podczas gdy jeden z nich wykonany został w konwencji terapii ogniskowej. Poza wyżej wymienionymi procedurami wykonanymi w raku stercza, w Oddziale Klinicznym Urologii Onkologicznej w Bydgoszczy wykonano leczenie ogniskowe w nowotworze nerki i wątroby. Wszystkie procedury możliwe były dzięki uprzejmości firmy AngioDynamics – producenta aparatury NanoKnife oraz firmy Optimed Pro‐Office (generalny dystrybutor na teren Polski). Niestety, na razie brak perspektyw na umieszczenie procedury w katalogu świadczeń NFZ.
lek. Andrzej Wronczewski
Oddział Kliniczny Urologii Onkologicznej
Uniwersyteckie Centrum Kliniczne w Bydgoszczy
dr n. med. Jerzy Siekiera
Oddział Kliniczny Urologii Onkologicznej
Uniwersyteckie Centrum Kliniczne w Bydgoszczy (koordynator)
prof. dr hab. n. med. Michał Studniarek
Zakład Diagnostyki Obrazowej i Radiologii Interwencyjnej
Uniwersyteckie Centrum Kliniczne w Bydgoszczy
Piśmiennictwo:
- Rubinsky B, Onik G, Mikus P: Irreversible electroporation: a new ablation modality-clinical implications. Technol Cancer Res Treat 2007; 6(1): 37-48.
- Neumann E, Schaefer-Ridder M, Wang Y, Hofschneider PH, et al.: Gene transfer into mouse lyoma cells by electroporation in high electric fields. J.EMBO 1982; 1: 841-845.
- Mir LM, Belehradek M, Domenge C, Luboniski B, Orlowski S, Belehradek J, Schwaab B, Luboniski B, Paoletti C: Electrochemotherapy, a novel antitumor treatment: first clinical trial. C.R.Acad Sci 1991; Ser. III 313: 613-618.
- Davalos RV, Mir LM, Rubinsky B: Tissue ablation with irreversible electroporation. Annals of Biomedical Engineering 2005; 33(2): 223-231.
- Onik G, Mikus P, Rubinsky B: Irreversible electroporation: implications for prostate ablation. Technol Cancer Res Treat 2007; 6(4): 295-300.
- Donnelly BJ, Salikan JC, Ernst DS, et al.: Prospective trial of cryosurgical ablation of the prostate: Five year results. Urology 2002; 60(4): 645.
- Onik G, Narayan P, Vaughan D, et al.: Focal nerve sparing cryoablation for the treatment of primary prostate cancer: A new approach to preserving potency. Urology2002; 60(1): 109-114.
- Djavan B, Susani M, Bursa B, et al.: Predictability and significance of multifocal prostate cancer in the radical prostatectomy specimen. Techniques in Urology 1999; 5(3): 139-142.
- Villars A, Mc Neal JE, Freiha FS, et al: Multiple cancers in the prostate. Morphological features of clinically recognized vs. incidental tumors. Urology 2002; 60(2A); 19-25.
- Noguchi M, Stamey TA, McNeal JE, et al: Prognostic factors for multifocal prostate cancer in radical prostatectomy specimens: Lack of significance of secondary tumors. J Urol 2003: 170(2pt): 459-463.
- Rukstalis DB, Goldknopf JL, Crowley EM, et al.: Prostate cryoablation: A scientific rationale for future modifications. Urology 2002; 60(2A): 19-25.
- Bostwick DG, Waters DJ, Farley ER, Meiers I, Rukstalis D, Cavanaugh WA, Ragde H, Dineen MK, Bahn D, Scionti S, Babian R, Ellis DS, Rewcastle JC, Burke HB, Andriole GL, Onik G, Barqawi AE, Maksem J, Barzell WE: Group consensus reports from the Consensus Conference on Focal Treatment of Prostatic Carcinoma, Celebration. Florida (February 24, 2006). Urology (December 2007); 70 (suppl. 6): 42-44.
- Crawford ED, Wilson SS, Torkko KC, at al.: Clinical staging of prostate cancer: A computer-simulated study of transperineal prostate biopsy. BJU Int 2005; 96(7): 999-1004.

